![]()
Les microalgues représentent aujourd’hui une ressource prometteuse pour la production de molécules à haute valeur ajoutée et de biocarburants. Cependant, leur récolte est actuellement un frein à leur exploitation à grande échelle. Des chercheurs du Laboratoire d’Ingénierie des Systèmes Biologiques et des Procédés (LISBP, Toulouse) montrent l’apport de la microscopie à force atomique pour décrypter les interactions entre les microalgues, leur milieu de culture et des interfaces gaz-liquide, et ainsi élucider le mécanisme de récolte par floculation/flottation. Ces travaux, qui ouvrent de nouvelles perspectives dans l’optimisation de méthodes de récolte efficaces, sont publiés dans le journal Algal Research.
 Dans le contexte du changement climatique, l’intérêt pour les sources d’énergie renouvelables grandit. Les microalgues constituent une ressource prometteuse pour la production de biocarburants en raison de leur importante capacité à produire des lipides. Mais, à l’heure actuelle, leur utilisation industrielle est limitée par l’absence de techniques de récolte efficaces. La récolte consiste à séparer les microalgues de leur milieu de culture aqueux, où leur concentration est très faible (quelques grammes par litre) tout en conservant leur paroi cellulaire intacte pour ne pas perdre leur production en solution.
Dans le contexte du changement climatique, l’intérêt pour les sources d’énergie renouvelables grandit. Les microalgues constituent une ressource prometteuse pour la production de biocarburants en raison de leur importante capacité à produire des lipides. Mais, à l’heure actuelle, leur utilisation industrielle est limitée par l’absence de techniques de récolte efficaces. La récolte consiste à séparer les microalgues de leur milieu de culture aqueux, où leur concentration est très faible (quelques grammes par litre) tout en conservant leur paroi cellulaire intacte pour ne pas perdre leur production en solution.
La flottation est actuellement la technique de récolte la plus prometteuse : elle consiste à générer des bulles d’air ou de gaz dans une suspension de microalgues, auxquelles les cellules se fixent, conduisant alors à leur accumulation en surface. L’efficacité de cette technique peut être améliorée grâce à la floculation préalable des cellules, en large flocs facilement séparables de l’eau par les bulles en ascension, grâce notamment à des mécanismes d’auto-floculation.
Il existe plusieurs mécanismes d’auto-floculation connus, dont l’un repose sur la précipitation à pH élevé des ions magnésium, présents dans l’eau de mer, en hydroxyde de magnésium. Celui-ci, chargé positivement, permet alors de floculer les cellules, et ce par un mécanisme de neutralisation de charges. Cependant, pour le moment, il n’y a pas de preuve ni de caractérisation des interactions entre les cellules et l’hydroxyde de magnésium qui pourraient confirmer ou compléter les connaissances sur ce mécanisme. De plus, les effets d’un pH élevé sur les cellules n’ont jamais été étudiés bien que la modification de surface des cellules à un tel pH puisse participer au mécanisme de floculation/flottation.
Pour répondre à ces questions, nous avons mis au point une approche multi-échelles pour comprendre le mécanisme de floculation/flottation médié par l’hydroxyde de magnésium de cellules de Phaeodactylum tricornutum, une diatomée productrice de lipides, à pH élevé. Dans un premier temps, l’équipe a d’abord effectué des tests de flottation, qui ont permis de quantifier à l’échelle de la population l’efficacité de l’hydroxyde de magnésium en tant que floculant. Ces expériences ont mis en avant l’effet positif dose-dépendant de l’hydroxyde de magnésium pour la floculation/flottation de P. tricornutum ; elles ont également révélé le rôle inattendu de la seule augmentation du pH dans la flottation des cellules. Dans un second temps, les chercheurs sont descendus à l’échelle du micromètre, en utilisant la microscopie à force atomique pour visualiser et sonder les propriétés mécaniques de cellules de P. tricornutum à différents pH. Ces expériences ont permis de mettre en évidence les changements structuraux induits par l’augmentation du pH sur la paroi des cellules, reflétés par une forte augmentation de sa rigidité, permettant une meilleure interaction avec les bulles. Enfin, dans un troisième temps, pour étudier les interactions à l’échelle moléculaire entre l’hydroxyde de magnésium et les cellules, nous avons développé une stratégie originale pour fonctionnaliser des pointes AFM avec des particules d’hydroxyde. Ces pointes, ensuite utilisées dans des expériences d’imagerie multiparamétrique, ont permis de comprendre à l’échelle moléculaire les forces conduisant à l’adhésion entre les particules d’hydroxyde et les cellules, montrant que ces interactions sont fortes (environ 120pN), non spécifiques, et de type électrostatiques.
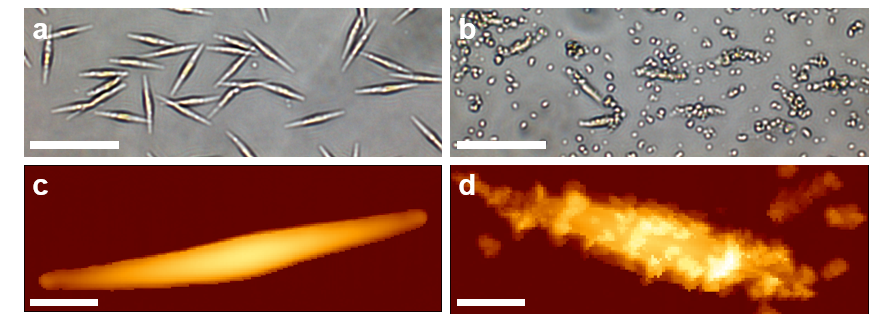 Figure 2 : Effets de la flottation sur la surface cellulaire de P. tricornutum. (a) Image optique des cellules avant la flottation en milieu tampon à pH = 10, ou (b) après flottation en milieu tampon pH = 10 contenant Mg(OH)2 à une concentration de 5,7 mM. (c) Image de hauteur AFM d’une cellule de P. tricornutum avant la flottation, ou (d) après flottation en milieu tampon pH = 10 contenant Mg(OH)2 à une concentration de 5,7 mM.
Figure 2 : Effets de la flottation sur la surface cellulaire de P. tricornutum. (a) Image optique des cellules avant la flottation en milieu tampon à pH = 10, ou (b) après flottation en milieu tampon pH = 10 contenant Mg(OH)2 à une concentration de 5,7 mM. (c) Image de hauteur AFM d’une cellule de P. tricornutum avant la flottation, ou (d) après flottation en milieu tampon pH = 10 contenant Mg(OH)2 à une concentration de 5,7 mM.
Au final, l’ensemble des résultats obtenus permet de mieux comprendre les mécanismes sous-jacents à la floculation/flottation alcaline. Ils mettent notamment en lumière le rôle de la paroi des cellules dans ces mécanismes, et plus particulièrement dans l’interaction avec les particules d’hydroxydes mais aussi avec les bulles. La floculation/flottation médiée par l’hydroxyde de magnésium est donc un système à deux composantes ; à la fois les modifications subies par la paroi des cellules et ses interactions avec les particules d’hydroxydes sont nécessaires pour récolter de façon efficace les cellules. Ces nouvelles informations ouvrent alors de nouvelles voies pour améliorer et optimiser la récolte de microalgues. De nouveaux travaux sont actuellement en cours pour mesurer à l’échelle moléculaires les interactions entre des interfaces gaz/liquide, fonctionnalisées ou non, et les cellules, afin d’aller plus loin dans la compréhension des mécanismes fondamentaux de la flottation des cellules vivantes en milieu complexe.
Référence publication :
Towards a better understanding of the flocculation/flotation mechanism of the marine microalgae Phaeodactylum tricornutum under increased pH using atomic force microscopy
- Formosa-Daguea,b,c, V. Gernigona, M. Castelaina,c, F. Daboussia, P. Guirauda,c
a LISBP, Université de Toulouse, INSA, INRA, CNRS, Toulouse, France
b LAAS-CNRS, Université de Toulouse, CNRS, Toulouse, France
c Fédération de Recherche FERMAT, CNRS, Toulouse, France
Algal Research 33 (2018) 369–378
Contacts: Cécile Formosa-Dague, formosa@insa-toulouse.fr
Pascal Guiraud, pguiraud@insa-toulouse.fr