L’environnement biologique peut perturber le fonctionnement des enzymes et modifier leur classification
Les enzymes sont classées suivant une nomenclature très précise qui indique quelles réactions elles catalysent. En cherchant à synthétiser du β-carotène, des scientifiques du laboratoire TBI ont montré que, dans certaines conditions biologiques, cette classification peut être caduque. Selon leurs travaux publiés dans la revue Scientific Report, les réactions catalysées par des enzymes isolées ou insérées dans des microorganismes ne sont pas identiques à celles prévues par leur classification.
Merveilleuses usines chimiques du vivant, les enzymes sont classées en fonction des réactions qu’elles catalysent. Cette nomenclature est essentielle pour la biochimie, mais également pour les biotechnologies. Elle permet de choisir les enzymes en fonction des réactions que l’on veut effectuer pour aboutir au produit souhaité, car il est souvent trop coûteux et peu efficace de passer par les organismes qui le sécrètent naturellement. L’ingénierie métabolique propose à la place de modifier génétiquement des levures ou des bactéries en insérant les enzymes pouvant former la molécule. Deux chercheurs du Toulouse Biotechnology Institute (TBI, CNRS/Inrae/INSA Toulouse), travaillant sur la synthèse du β-carotène, ont constaté que la classification actuelle de certaines enzymes impliquées dans sa formation n’était pas complètement fiable.
La biosynthèse de β-carotène fait intervenir plusieurs enzymes, dont la phytoène désaturase. Plusieurs types de désaturases existent, elles sont classées selon le nombre de réactions qu’elles peuvent réaliser sur un même substrat de départ (le phytoène). Etudiées in vitro après purification ou insérées dans des levures, les phytoène désaturases ont cependant réalisé plus de réactions que ce qui était prévu par leur classification. Les chercheurs ont ainsi constaté que le comportement des enzymes dépend en partie des conditions biologiques : placées dans un autre micro-organisme que celui d’origine et en présence de molécules qui entrent en compétition, des différences non négligeables apparaissent. L’équipe estime que le meilleur moyen d’obtenir un produit donné par voie biotechnologique consisterait à tester, dans les conditions biologiques de production, plusieurs enzymes de familles assez proches plutôt que de se concentrer uniquement sur l’enzyme que la classification désigne comme la plus adaptée.
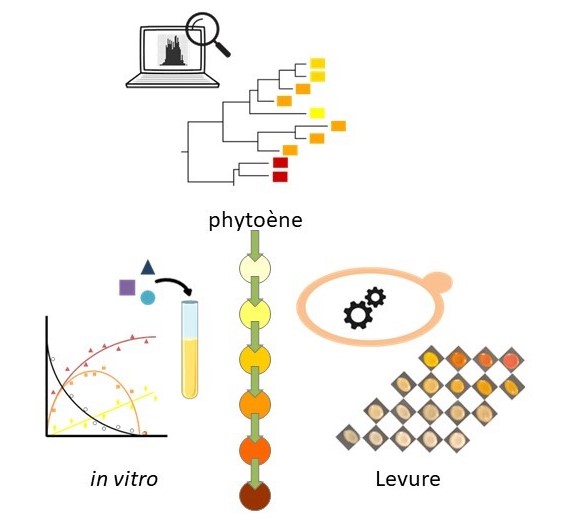
© Gilles Truan (TBI, CNRS/Inrae/INSA Toulouse)
Références
Multiplicity of carotene patterns derives from competition between phytoene desaturase diversification and biological environments.
M. Fournié & G Truan
Scientific Reports volume 10, Article number : 21106 (2020).
https://doi.org/10.1038/s41598-020-77876-4
Contact : Gilles Truan, Directeur de recherche CNRS à TBI (CNRS/Inrae/INSA Toulouse), gilles.truan@insa-toulouse.fr

